7月8日讯 为推动药品专利链接制度落地,最高法自7月5日起施行《关于审理申请注册的药品相关的专利权纠纷民事案件适用法律若干问题的规定》这一司法解释,为国家药监局、国家知识产权局发布的《药品专利纠纷早期解决机制实施办法(试行)》完善司法衔接。
国家层面最近密集对专利保护出台了相应政策法规,以促进创新药、仿制药的高质量发展。只不过,相较于创新药而言,在国采、一致性评价等政策合力下,仿制药市场大幅缩水让仿药立项的机会更加受业界关注。夹缝中找机会,机会何在?前述一系列专利保护新机制支了大招:新政按程序对相关化学仿制药注册申请设置9个月等待期,对首个挑战专利成功并首个获批上市的化学仿制药给予12个月市场独占期。
鼓励挑战专利,支持首仿,国内仿制药或将迎来新的竞争格局。
市场缩水,考验企业立项能力
之所以说立项也是一种能力,主要是因为仿制药市场发生着巨变。
第五批国采尘埃落地,但仿制药市场的总体缩水已是不可逆转的趋势。梳理前几轮国采的实际情况,有机构进行了粗略统计,仅医院终端,第一轮国家集采中选的25个品种2020年总销售额为292.50亿元,与2018年的547.44亿元相比,市场规模萎缩46.57%,总销量则从83.05亿剂增至99.48亿剂,增长19.78%。其中,原研药总销售额从297.60亿元下降至140.47亿元,总销量从28.30亿剂下降至19.48亿剂;仿制药总销售额则从267.84亿元下降至152.03亿元,总销量从54.75亿剂上升至80.01亿剂,仿制药处方率从65.82%上升至80.42%。这组数据虽然说明了仿制药替代效应明显,但可以看到,总体量大幅缩水。由此需要深思的是,仿药立项未来究竟机会何在?
这是一个更值得思考的问题,很多人把仿制药立项称为在狭缝中找机会。
上述专利政策法规的建立、完善,包括药品专利链接制度的早期解决机制,既有利于原研药企业,也会促进原研药和仿制药的良性发展。尤其是,对首个挑战专利成功并首个获批上市的化学仿制药,给予市场独占期。市场人士指出:“虽说就首仿药而言,此前的文件及相关政策均有鼓励,尤其是挑战专利,不少企业都取得了很好的成绩,在医保支付等环节也有一定的倾斜。不过,从法律法规的角度来说,仿制药做一致性评价投入很大,专利文件规定了12个月独占期,对头部具有研发能力的企业发展高质量仿制药具有积极作用,对手握多个首仿药的本土药企是利好。法律层面厘清了,企业就好专注于技术创新。”
客观来讲,药品专利一直是业界非常纠结的话题。有报告显示,仅2017-2019年,就有跨国药企的38款原研药物在中国被提起专利权无效请求,已作出的审查决定中全部无效33件(占55%),部分无效20件(占33%),维持有效7件(占12%)。2020年约18款跨国药企原研药品相关的24件专利遭到中国药企或机构提出专利挑战,涉及国家知识产权局作出的26项决定号,全部无效决定占54%。
从当前仿制药的竞争环境来分析,仿制药立项将更注重低成本的技术比较优势。有两点显得格外重要:一是原料药是否可及。这是产生成本优势的基础;二是技术转化速度。不少头部企业选择小众领域精选立项,如吸入制剂、缓控释制剂等领域很受欢迎。这些归根到底考验的就是企业的产品结构及梯队布局,抢占首仿药市场就是立项能力的体现。
抢先机!头部企业竞跑
仿制药机会究竟在哪里?头部企业用行动给出了答案。
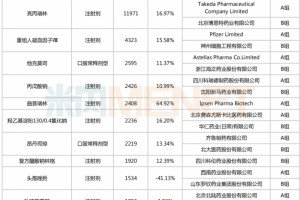
正大天晴就是名副其实的急先锋。米内网数据库显示,从已过评和分类报产的仿制药情况看,正大天晴目前有近20个品种首家过评,其中注射用唑来膦酸浓溶液、泊马度胺胶囊、甲磺酸伊马替尼胶囊等5个品种为独家过评。
而目前其在审的新注册分类报产仿制药有20个,14个暂无首仿获批。且看正大天晴瞄准的品种:甲磺酸仑伐替尼胶囊、依维莫司片、右兰索拉唑肠溶胶囊等以新分类报产。而依维莫司、乌美溴铵维兰特罗、氟替卡松维兰特罗2020年全球销售额分别为15.35亿美元、5.47亿英镑、11.24亿英镑。
从这个维度看,恒瑞医药的布局也显得精巧。3月3日,恒瑞医药的3类仿制药托伐普坦片以首仿+首家过评的方式获批生产,这是继盐酸右美托咪定氯化钠注射液后,该公司今年获批的第2款首仿。目前恒瑞有43个品种以新分类报产,其中15个已获批生产并过评(含8个首仿);在审的28个品种中,有17个暂无首仿(含剂型首仿)获批。
“巧”字体现在:如沙美特罗替卡松是由β2-激动剂及糖皮质激素组合而成的抗哮喘吸入剂,2013年达到52.74亿英镑的销售峰值,2020年全球销售额为15.35亿英镑;舒更葡糖钠是全球首个选择肌松拮抗剂,2020年全球销售额为11.98亿美元。14个品种由恒瑞医药首家/独家以新分类报产,其中麦考酚钠肠溶片已进入行政审批阶段。
扬子江则选择在神经系统药物、全身用抗感染药物等领域发力。此前,其首家以3类提交布立西坦注射液上市申请,该产品暂无仿制药获批。目前该公司有107个品种以新注册分类报产。米内网数据显示,2019年中国公立医疗机构终端全身用抗感染药物、神经系统药物市场规模分别突破2000亿元、1000亿元。扬子江在审的87个品种在2019年中国公立医疗机构终端销售额合计销售规模超过700亿元,其中有22个在国内市场暂未有首仿获批上市。
除普通制剂外,近些年由于缓控释制剂临床优势明显,行业内在制剂创新方面也突飞猛进。2020年中国公立医疗机构终端缓控释制剂销售规模接近300亿元,如琥珀酸美托洛尔缓释片、非洛地平缓释片、格列齐特缓释片、盐酸坦索罗辛缓释胶囊及二甲双胍缓释片等。其中硝苯地平控释片销售额突破50亿元,琥珀酸美托洛尔缓释片暂无首仿获批。人福医药6款缓控释制剂抢首仿,其中盐酸他喷他多缓释片、盐酸氢吗/啡/酮缓释片首家或独家报产。
《药品专利纠纷早期解决机制实施办法(试行)》
政策解读
一、《药品专利纠纷早期解决机制实施办法(试行)》起草背景是什么?
药品专利纠纷早期解决机制是指将相关药品上市审批程序与相关药品专利纠纷解决程序相衔接的制度。中共中央办公厅、国务院办公厅印发的《关于深化审评审批制度改革鼓励药品医疗器械创新的意见》《关于强化知识产权保护的意见》均提出要探索建立药品专利链接制度。2020年10月,新修正的《中华人民共和国专利法》(以下简称《专利法》)第七十六条引入药品专利纠纷早期解决的有关规定,明确由国务院药品监督管理部门会同国务院专利行政部门制定药品上市许可审批与药品上市许可申请阶段专利纠纷解决的具体衔接办法,报国务院同意后实施。
为贯彻落实党中央、国务院决策部署,推动建立我国药品专利纠纷早期解决机制,国家药监局、国家知识产权局会同有关部门在新修正的《专利法》相关规定的框架下,就药品专利纠纷早期解决机制的具体制度认真研究,借鉴国际做法,在广泛征求业界、协会、专家等意见并完善后,制定了《药品专利纠纷早期解决机制实施办法(试行)》(以下简称《办法》)。
二、《办法》目的和主要内容是什么?
《办法》旨在为当事人在相关药品上市审评审批环节提供相关专利纠纷解决的机制,保护药品专利权人合法权益,降低仿制药上市后专利侵权风险。《办法》的主要内容包括:平台建设和信息公开制度、专利权登记制度、仿制药专利声明制度、司法链接和行政链接制度、批准等待期制度、药品审评审批分类处理制度、首仿药市场独占期制度等。
三、药品专利纠纷早期解决的途径有哪些?
《办法》规定,专利权人或者利害关系人对四类专利声明有异议的,可以就申请上市药品的相关技术方案是否落入相关专利权保护范围向人民法院提起诉讼或者向国务院专利行政部门请求行政裁决,即:司法途径和行政途径。在规定的期限内,专利权人可以自行选择途径。如果当事人选择向国务院专利行政部门请求行政裁决,对行政裁决不服又向人民法院提起行政诉讼的,等待期并不延长。
专利权人或者利害关系人未在规定期限内提起诉讼或者请求行政裁决的,仿制药申请人可以按相关规定提起诉讼或者请求行政裁决,以确认其相关药品技术方案不落入相关专利权保护范围。
四、药品专利纠纷早期解决机制涵盖的相关药品专利有哪些?
可以在中国上市药品专利信息登记平台中登记的具体药品专利包括:化学药品(不含原料药)的药物活性成分化合物专利、含活性成分的药物组合物专利、医药用途专利;中药的中药组合物专利、中药提取物专利、医药用途专利;生物制品的活性成分的序列结构专利、医药用途专利。相关专利不包括中间体、代谢产物、晶型、制备方法、检测方法等的专利。
五、如何进行专利声明?
化学仿制药申请人、中药同名同方药申请人、生物类似药申请人提交药品上市许可申请时,应当对照已在中国上市药品专利信息登记平台公开的专利信息,针对被仿制药每一件相关的药品专利作出声明。仿制药申请被受理后10个工作日内,仿制药申请人应当将相应声明及声明依据通知上市许可持有人。其中,声明未落入相关专利权保护范围的,声明依据应当包括仿制药技术方案与相关专利的相关权利要求对比表及相关技术资料。除纸质资料外,仿制药申请人还应当向上市许可持有人在中国上市药品专利信息登记平台登记的电子邮箱发送声明及声明依据,并留存相关记录。
六、如何启动等待期?
专利权人或者利害关系人对化学仿制药注册申请的四类专利声明有异议的,可以自国家药品审评机构公开药品上市许可申请之日起45日内,就申请上市药品的相关技术方案是否落入相关专利权保护范围向人民法院提起诉讼或者向国务院专利行政部门请求行政裁决。专利权人或者利害关系人如在规定期限内提起诉讼或者请求行政裁决,应当自人民法院立案或者国务院专利行政部门受理之日起15个工作日内将立案或受理通知书副本提交国家药品审评机构,并通知仿制药申请人。收到人民法院立案或者国务院专利行政部门受理通知书副本后,国务院药品监督管理部门对化学仿制药注册申请设置9个月的等待期。
对化学仿制药申请人声明中国上市药品专利信息登记平台收录的被仿制药相关专利权应当被宣告无效的,如果专利权人或者利害关系人未就上市药品的相关技术方案是否落入相关专利权保护范围向人民法院提起诉讼或者向国务院专利行政部门请求行政裁决,不启动等待期。
七、未早期解决专利纠纷的,相关药品上市后如何处理?
未在中国上市药品专利信息登记平台登记相关专利信息的,不适用本办法;专利权人或者利害关系人未在规定期限内提起诉讼或者请求行政裁决的,不设置等待期。对此类未能早期解决专利纠纷的,相关药品获批上市后,如专利权人认为相关药品侵犯其相应专利权,引起纠纷的,依据《中华人民共和国专利法》等法律法规的规定解决。已经依法批准的药品上市许可决定不予撤销,不影响其效力。